着床前診断(PGT-A、PGT-SR、PGT-M)について
着床前診断とは、体外受精を行った胚の栄養外胚葉(trophectoderm: TE)細胞を5~10細胞生検し、染色体や遺伝子の検査を行い、異常を持たないもしくは少ない胚を選択し、子宮に移植する技術のことです。
従来の着床前診断(PGD)は、
・PGT-A (Preimplantation genetic testing for aneuploidy)
・PGT-SR (Preimplantation genetic testing for structural rearrangements)
・PGT-M (Preimplantation genetic testing for monogenic)
の3つに区分されました。PGT-Aは胚の染色体の数的異常を確認する検査で、PGT-SR は胚の染色体の構造異常を確認する検査であり、カップルの染色体構造異常による不育症が対象となります。PGT-Mは単一遺伝子の異常に基づく遺伝性疾患を対象とする着床前診断です。
PGT-Aの自費診療に関して
現在当院ではPGT-Aの先進医療Bの正式な開始を待っていますが、目途はたっていません。高齢の方は時間が遅れることは良くないので、認可が下りるまで自費診療によるPGT-Aを開始した方が良く、胚盤胞が沢山とれる方々はぜひPGT-Aをおすすめします。自費診療のため費用は高くなりますので、経済的支援を検討いたします。PGT-Aをするには胚盤胞が必要ですので胚盤胞に発育しない方、35歳未満の方はPGT-Aの適応にはなりません。ぜひ良い結果を出しましょう。
PGT-A
ART施行者の高齢化と胚の染色体異常
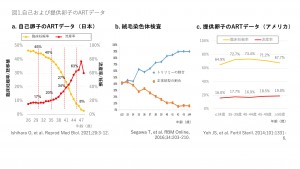
日本のARTの現状は他国と大きく異なり、2018年のART施行者数の年齢別推移(日本産婦人科学会)では最も多い年齢は40歳で、40歳以上が40%以上を占め世界の中でART施行者の年齢は最も高齢であると思われます。日本のARTの妊娠成績では、30歳代の胚移植における臨床妊娠率40-45%、流産率15-20%に対し、40歳になると妊娠率34%、流産率27%で、45歳では妊娠率がわずか8%でそのうち63%が流産でした(図1a)。着床しないもしくは流産する胚のほとんどが染色体異常のある胚です。流産後の絨毛染色体検査結果でも年齢とともに染色体数的異常が増加し、正常核型が減少しています(図1b)。そのため、アメリカの提供卵子を用いたARTでは年齢により妊娠率がほとんど変化しません(図1)。つまり患者の高齢化が進むとPGT-Aが必要となる、と考えられます。
胚の染色体異常の原因
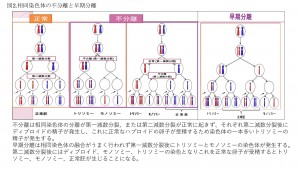
胚の染色体異常の最も代表的な原因としては相同染色体の不分離と早期分離が挙げられます。減数分裂では一対の父親・母親由来の相同染色体がそれぞれ体細胞分裂と異なり相同染色体がそれぞれ分離し、第二減数分裂ではそれぞれの二本の相同染色体が一本ずつに分かれます。染色体の分離が正しく行われないで娘細胞にそのまま入ってしまいます。
第一減数分裂では相同染色体に第二減数分裂では染色分体に不分離が生じると4種類のトリソミーが生じます(XXX, XXY, YYX, YYY)。これに対しXY染色体のない細胞に精子が受精するとモノソミーとなります(図2)。
染色体早期分離は、相同染色体が減数分裂に入る前にそれぞれの娘染色体の結合が阻害され相同染色体と成ることができずに個々の娘染色体のまま減数分裂に入ってしまう現象です。その結果、一本の娘染色体と相同染色体をもつ卵子と一本の娘染色体をもつ卵子とに別れ、それぞれが第二減数分裂でダイソミックな卵子と正常な一倍体(半数体)の卵子と、染色体をもたない卵子が発生します(図2)。これに正常な精子が受精することによりトリソミー、モノソミー及び正常な染色体が発生します。西野らは、この染色体異常の早期分離が老化卵子で高率に発生することを報告しています。当院においても、 この老化卵子のM期の染色体を分析してみると、高頻度で早期分離が起きていることを確認しております(図3)。
PGT-Aの対象および実施施設の要件
日本産科婦人科学会はPGT-Aの対象は以下のように決められています。
①反復する体外受精・胚移植の不成功の既往を有する不妊症の夫婦。
②反復する流死産の既往を有する不育症の夫婦。
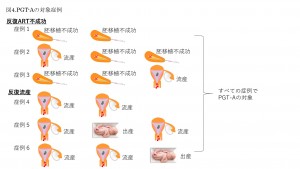
ただし,夫婦のいずれかに染色体構造異常(均衡型染色体転座など)が確認されている場合を除く、とされています。つまり、PGT-SRの対象となる不育症は、PGT-Aと分けて行うこと規定しています。またART不成功、流産のそれぞれの反復については連続である必要はなく、2回以上の既往があれば対象となる。図4は、PGT-A実施可能な症例です。
PGT-Aの実施施設は日本産科婦人科学会による指針を順守し承認を受けていれば、遺伝専門家としてその生殖医療専門医がいなくても認められていましたが、2022年1月9日の見解改訂により生殖医療専門医の常勤が必須となりました。また、遺伝専門医が常勤していなくても外部施設に勤務している遺伝専門医からの説明が随時可能な体制であれば実施施設として認めることとしました。すなわち患者に遺伝カウンセリングを提供できる体制が十分に取れていることがPGT-Aを実施する為に必須の条件となります。
また、2022年5月現在、PGT-Aは日本産科婦人科学会の臨床研究として行われているため、上記を遵守し施行しなければなりません。
PGT-Aの実際の流れ
1. 反復妊娠不成功既往のあるPGT-Aの対象となる夫婦に十分な説明をし、インフォームド・コンセントを得ます。
2. 日本産科婦人科学会PGT-A小委員会に登録します。
3. 入力プログラムから「反復ART不成功の場合」「反復流産の場合」「夫婦いずれかに染色体構造異常をもつ場合」の三つの中から選択します。次にそれぞれの対象を選択、患者背景の中で選択基準に関して内容を選択します。
4. ARTを行い胚盤胞まで発育した後に、拡張期胚盤胞に発育した内部細胞塊の対極の栄養芽細胞を採取します。この胚生検には一般的に胚生検にレーザーを用いているがレーザーの熱による細胞の損傷を考え、現在では細い針で透明帯を串刺しにして穴を空けています。その後3時間ほど放置すると栄養膜細胞が自然に飛び出してくるので針で吸い、これをホールディングピペットとの間で物理的にこすって取ります。この方法が最も胚の損傷が少なく、短時間で済み、最も優れた方法であると考えます(図5)。ただしこの技術は高度な技術が必要です。このように取り出した細胞5~10個と胚をそれぞれ分けて凍結します。年齢に応じたサンプル数に達した時点でこのサンプルを検査会社に出します。この検査会社は日本産科婦人科学会の小委員会の認定した施設に限られ、提出後診断された胚の結果は2~3週間以内に
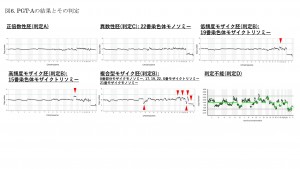
A判定:染色体数が正倍数胚
B判定:モザイク胚
C判定:異数性胚
D判定:ダメージが強く判定不能
の4つに分けられ、結果が実施医療施設に郵送されます(図6)。
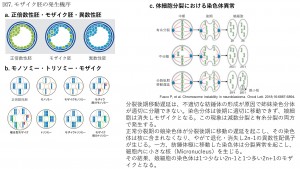
モザイク胚とは
モザイクとは、胚生検によって採取した細胞塊に染色体異数性をもたない細胞と染色体異数性をもつ細胞が混在している状態(図7a)で、日本産科婦人科学会の判定ではBとなります。この判定には様々なパターンがあります。染色体のコピー数が採取した胚の一部分(15-30%)の場合が低頻度モザイク、胚の大部分(70-90%)を認める場合は高頻度モザイクと診断されます。モノソミー胚が混在する場合はモザイクモノソミー、トリソミー胚が混在している場合はモザイクトリソミー、各々の染色体異常が染色体全体の場合が一般的ですが、染色体の異常の位置が正常の20-80%の場合に部分的(セグメンタル)モザイクをモザイク部分トリソミー、モザイク部分モノソミーと診断されます。複数の染色体のモザイクが混在している場合は複雑モザイク(複合型)と診断されます(図7b)。
モザイクの発生機序
発生機序には①Non-disjunction(不分離)、②Anaphase-lagging(分裂後期移動遅延)があります(図7c)。Non-disjunctionは、体細胞分裂時に赤道面状に並んだM期の染色体が紡錘体に吸引され双極に分離する際、一本の染色体が一極に残り他極に分離しない状態のことです。その結果、二細胞となった際2n+1と2n-1のモザイク胚が生じます。Anaphase-laggingは、体細胞分裂は開始するがAnaphaseで進行が止まってしまい、その結果、2n-1と2n+1となります。
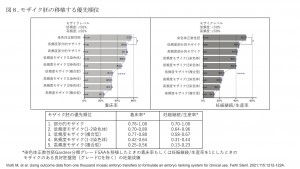
モザイク胚の優先順位
まずモザイクの染色体が増加か減少か、モザイク量が全体の何%にあたるのか、全体モザイクなのか部分的なのか、単一か複合型か、の四つの点より判定します。これらを踏まえて、5,561個の正倍数性胚と1,000個のモザイク胚を実際に胚移植した妊娠成績の報告があります(図8)。この結果から、部分的モザイクは低頻度でも高頻度でもほとんど妊娠成績に差がなく良好な成績で、あとはモザイクが低頻度で、かつ異数性の染色体数が少ない方が成績良好である。この結果から、モザイク胚の胚移植における優先順位は、
①部分的モザイク
②低頻度モザイク(1-2染色体)
③低頻度モザイク(複合型)
④高頻度モザイク(1-2染色体)
⑤高頻度モザイク(複合型)
となります。複合型モザイク胚は従来胚移植をしない方針でしたが、最近の再度胚生検を行った報告では、正倍数性胚が61.6%(53/86)でした(7) 。胚移植の優先順位は最下位ですが、患者の年齢、PGT-Aの判定の状態により、正倍数性胚が無い場合には十分なインフォームド・コンセントの後に胚移植が検討されます。
PGDIS(Preimplantation Genetic Diagnosis International Society)のモザイク胚の見解
国際的な着床前診断の学会であるPGDISは、2016年にニュースレターで以下のモザイク胚に対する見解を出しています。
① モザイクモノソミーを優先(45Xを除く)
② モザイクトリソミー(単一の染色体で): モザイクのレベルと染色体種類を考慮して、以下の通り優先順位を決める。
1. 移植可能トリソミー:1,3,4,5,6,8,9,10,11,12,17,19,20,22番染色体、X,Y染色体
2. 片親性ダイソミー:(14,15番染色体:Prader-Willi症候群、Angelman症候群)と 子宮内胎児発育不全に関連するトリソミー(2,7,16番染色体)は優先順位を下げる
3. 生存可能なトリソミー(13,18,21番染色体)は最も優先順位を下げる
その後2019年に再度見解を出し、以下のように変更しています。
① 低頻度モザイクの胚移植を優先
② 単一染色体のモザイクの胚を移植する場合、特定の染色体疾患の起きる可能性のある染色体のモザイク胚は優先順位が下がる(2016年の提言に準じる)
これらのことから、モザイクに関しては、モノソミーかトリソミーかは関係なく低頻度モザイクを優先し、かつモノソミーの場合はX染色体以外、トリソミーの場合は2, 7, 13~16, 18, 21番染色体以外のモザイク胚を優先して移植することを推奨しています。
PGT-Aの臨床成績
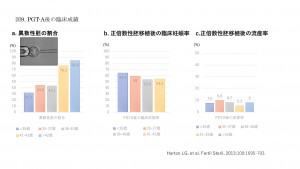
PGT-Aを施行したときの異数性胚の割合は年齢と比例します。アメリカにおけるPGT-Aの結果では、異数性胚の割合は35歳未満で31.7%、35~40歳で約44%、41-42歳で76.3%、43歳以上で84.8%でした(図9)。つまり、染色体正数性胚の割合は、35歳未満で2/3、35~40歳で1/2、41-42歳で1/4、43歳以上で1-2/10となります。また正数性胚を移植した後の臨床妊娠率は約6割で流産率は1割以下で、年齢での差はほとんどありません。
またモザイク胚を移植した後の妊娠成績は、2015年にはじめて18例で胚移植し6例が妊娠し、その全例の出産児が正常核型であったと報告されています。その後1,000個のモザイク胚を移植した出産症例についてもほぼすべての症例が正常核型と報告されています。しかし2番染色体の低頻度モザイクモノソミーの胚盤胞を移植し妊娠・出産後、児の末梢血染色体分析で2番染色に2%のモザイクモノソミー[mos45,XX,-2(2)/46,XX(98)]を認めた症例も報告されていますが、その児の身体能力・認知能力は正常でした。モザイクは体細胞における染色体異常であるため、トリソミーとモノソミーは表裏一体であることからこのような事が起こり得るという点については前もって患者に伝える必要があります。今までのモザイク胚の移植で有害事象はほとんどないが、モザイクはすべて安全と判断するのは危険です。モザイク胚を移植した際、特に高頻度や複合型モザイクの症例には、羊水検査も検討する必要があります。
PGT-Aにおけるカウンセリング
PGT-Aを行う前に患者様へのインフォームド・コンセントやカウンセリングは非常に重要です。ARTの妊娠成績は対胚移植で解析すると高くなりますが、正倍数性胚を獲得するには良好胚盤胞が41-42歳で4個、43歳以上では5-10個必要です。これらを集めるために複数回の採卵が必要であること、またPGT-Aに提出した胚が全て異数性である可能性も伝えておく必要があります。また一度のPGT-Aにかかる費用は、当院では胚盤胞が6個の場合は約70万円、10個の場合は約90万円と高額であり、これらすべてが異数性胚の場合に患者にとって大きなショックとなり得ることも説明する必要があります。
一方で胚盤胞が6個あってPGT-Aを行わない場合ですが、異数性胚を6回胚移植するとPGT-Aの費用よりさらに高額になり、かつ半年以上の期間を費やし妊娠できないことになります。つまり年齢ごとの異数性胚の割合により費用対効果を考慮してPGT-Aを行うか否かをよく相談する必要があります。PGT-Aは不良な妊娠成績の高齢患者に対しはっきりとした目標を設定することができ、患者も納得して治療を継続することができるという利点もあります。
胚の染色体の構造異常の着床前診断(PGT-SR)
PGT-SRは、PGT-Aの技術を用いて、不育症の原因となる染色体の構造異常を診断する方法です。染色体構造異常の大部分は均衡型相互転座や Robertson転座などの均衡型転座で、減数分裂の過程において不均衡な配偶子が一定頻度で形成されるため、流産あるいは不均衡型染色体異常をもつ児の出生の原因となります。
均衡型相互転座は、2本の染色体の長腕または短腕の一部分が切断し断片を交換した状態です。全体の染色体の数は正常であるため、保因者は表現型としては異常を認めません。減数分裂では、転座染色体2本と正常染色体2本の相同部位が対合して四価染色体が形成されます。分離様式は、交互分離・隣接Ⅰ型分離・隣接Ⅱ型分離・3:1分離・4:0分離のいずれかとなり、交互分離のみが正常または均衡型の配偶子を形成します。それ以外は、部分トリソミーや部分モノソミーなどの不均衡型となり、妊娠が成立した場合に多くが流産や死産の転帰となりますが、まれに不均衡型転座をもった児として出生することもあります。
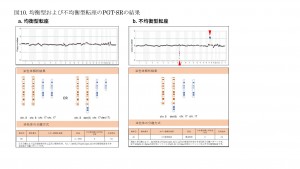
均衡型転座と不均衡型転座のPGT-SRの結果です(図10)。均衡型転座は転座の有無を判断することが難しいですが、不均衡型転座は結果から判断が可能です。
PGT-SRの妊娠成績
当院で行った染色体構造異常をもつ不育症に対するPGT-SR施行群と自然妊娠群の比較では、PGT-SR群で有意に流産率が低くなりましたが、累積生産率では有意差を認めませんでした。
単一遺伝子疾患の着床前診断(PGT-M)
着床前診断は、従来行われてきた出生前の遺伝学的検査と大きく異なる点は、生殖補助技術 (ART)が必須であることです。そして診断に用いられる遺伝学的検査も従来行われてきた手法でなく、ARTの特殊性を前提とした工夫が必要となります。従来の着床前診断は、PGT-A (Preimplantation genetic testing for aneuploidy)、PGT-SR (Preimplantation genetic testing for structural rearrangements)、PGT-M (Preimplantation genetic testing for monogenic)の3つに区分されました。PGT-Aは胚の染色体の数的異常を確認する検査で、あとで述べる条件の遺伝性を含みません。PGT-SR は胚の染色体の構造異常を確認する検査であり、カップルの均衡型相互転座やRobertson転座などの染色体構造異常による不育症が対象となります。PGT-Mは単一遺伝子の異常に基づく遺伝性疾患を対象とする着床前診断です。ここでは、PGT-Mについて概説いたします。
1.適応となる疾患の遺伝子異常の分類
1)適応疾患
PGT-Mは現時点では生児獲得されたのちの疾患を診断対象とすることで、疾患の重篤性に関しての倫理的な問題が論議となりました。生児獲得に至らない、子宮内胎児死亡に至る遺伝性疾患は、致死性(タナトフォリック)骨異形成症など数えるほどしか対象となっておりませんが、現在、死産遺伝子は数個同定されており、今後はこうした子宮内胎児死亡、死産に至る疾患の回避が含まれてくるものと考えられます。
今後の実施に向けて適応となる疾患について重篤性の定義が影響します。現時点で内定していることはこれまでの定義が「成人に達する以前に日常生活を著しく損なう状態が出現したり、生命の生存が危ぶまれる状況になる状態」から「原則、成人に達する以前に日常生活を強く損なう症状が出現したり、生存が危ぶまれる状況になる疾患で、現時点でそれを回避するために有効な治療法がないか、あるいは高度かつ侵襲度の高い治療を行う必要のある状態」となっています。また審査経験のない疾患申請に関しての適応の判断は専門学会(臨床と遺伝関連)に依頼することを必須とすることが但し書きとして追加されています。提出する意見書には「PGT-M を希望するご夫婦の生活背景や置かれた立場・考えも考慮し判断を行った結果を示す。」といったクライアントの状況に配慮した項目が含まれています。
2)適応となる遺伝子異常
現在、国内でPGT-Mが承認された遺伝性疾患が、下記の通りです。PGT-Mの適応は流動的であるが、その適応を遺伝子異常から分類します。
国内でPGT-Mが承認された遺伝性疾患
・Duchenne型筋ジストロフィー
・筋強直性ジストロフィー
・副腎白質ジストロフィー
・Leigh 脳症
・オルニチン・トランスカルバミラーゼ欠損症
・ピルビン酸脱水素酵素欠損症
・福山型筋ジストロフィー 骨形成不全症
・MTHFR欠損症
・SMA遺伝子変異
・レッシュナイハン症候群
・ミトコンドリア呼吸鎖複合体Ⅲ型異常BCS1L遺伝子コンパウンドヘテロ変異
(1)遺伝形式異常
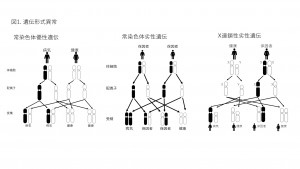
遺伝子の異常はその遺伝様式が影響します。単一遺伝子の異常に基づく遺伝性疾患は常染色体優性遺伝病、常染色体劣性遺伝病、X連鎖性劣性遺伝病に加えてインプリンティング病に分けられます。
(2)遺伝子異常
疾患の発症の原因となる遺伝子の病的バリアント(発症に関わる遺伝子変異)が遺伝子配列の塩基の置換、欠失、挿入が通常の単一遺伝子病の診断標的ですが、これは受精卵においても成人の診断と同じ手法を用いて診断が可能です。これに対して受精卵での診断に特化した遺伝子解析技術を必要とする疾患の病的バリアントは、筋緊張性ジストロフィーのリピート回数の伸長やX連鎖性のデュシェンヌ型筋ジストロフィー、常染色体劣性の脊髄性筋萎縮症のエクソンの欠失となります。
2.PGT-Mにおけるカウンセリング
PGT-Mのカウンセリングを求めるクライアントは大きく二つに分けられます。一つは自分の親族に遺伝性疾患があり、自分が保因者であるかの診断をしたい場合です。二つ目は、産まれた児に遺伝性疾患がみつかり夫婦が保因者であるか、もし保因者の場合は第二児が罹患しているかの診断です。前者はDuchenne型筋ジストロフィー、筋緊張性ジストロフィー、筋強直性ジストロフィー、後者は脊髄小脳変性症(SCD)が代表的です。カウンセリングの内容としては、以下の通りとなっております。
① クライアントの悩んでいる重篤な遺伝が果たして発端者が罹患している疾患と同一のものであるかを正しく評価する。
② 詳細な家系図、家系構成員の臨床症状に関する情報を詳しく集める。
③ 遺伝的リスク、すなわちメンデル遺伝のどの種類にあたるのか、又は非メンデル性の遺伝であるのかを診断し、その再発リスクを報告する。
④ 遺伝的リスクを推定する。筋緊張性ジストロフィーのように発症が高齢であり、反復数が明らかに高くない場合の診断は非常に困難である、そのような場合には出生前診断を行うという事も説明する。それらの検査のメリット、デメリットについても十分説明する。
ります。
3.遺伝子異常(病的バリアント)の検査法
1)受精卵を用いた遺伝学的検査
病因遺伝子の病的バリアントの直接診断に加えて、病的バリアントが存在するアレルの遺伝状況を調べることで間接的に診断の正確性を担保する、2段階で診断を行います。アレルは通常2つあり、父母より1つずつ受け継ぎます。常染色体優性遺伝では病的アレルを1つ、常染色体劣性遺伝では2つとも病的アレルで発症します。X連鎖性劣性遺伝では男子では病的アレル1つで発症、女子では保因者となります(図1)。
2)PGT-Mにおける遺伝子診断技術の特殊性について
受精卵診断では成人に行う検査と異なる遺伝子診断技術を必要とされます。羊水検査でも100個以上の細胞を対象とするのに対して、多くても10個前後の細胞を対象とする受精卵の診断では通常の遺伝子検査にはない診断の工夫が求められます。
(1)DNA量
血液から遺伝子診断を行う場合は、何万個のリンパ球細胞の核からDNAが抽出されるが、受精卵では細胞数が少なく極微量のDNAのため、増幅が必至となります。無作為に全部のDNAを増幅する全ゲノム増幅などの技術が進んで1の細胞からでも診断可能となってきているが、多量のDNAを必要とするサザンブロット法では難しく、PCR法でも検出が困難な量のDNAしか採取できません。
(2)DNA断片長
サザンブロット法に用いるDNAはできるだけ断片化させない、キロ単位の塩基の長さが求められますが、割球などからはキロ単位の長さのDNAは回収できません。PCR増幅についても鋳型となるDNA断片のサイズが少なくとも200塩基対以上のものが必要で、設定するプライマー間で切断が起きていないDNAが得られていないと増幅されなかったり、アレルドロップアウトと言われる片方のDNAしか増幅できない状況も生じます。
4.実際のPGT-Mを施行した症例
当院では、2022年2月までに日本産科婦人科学会へPGT-Mの申請を12例行っています。その中から例を挙げて紹介する。
症例1.Duchenne型筋ジストロフィー
Duchenne型筋ジストロフィーは、筋ジストロフィー症の中で最も頻度が高い疾患で、幼児期から始まる筋力低下・動揺性歩行・登攀性歩行・仮性肥大を特徴とするX連鎖劣性遺伝病です。20歳前後には呼吸障害や心不全で亡くなることからPGT-Mの適応となります。
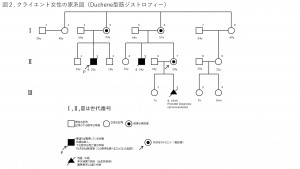
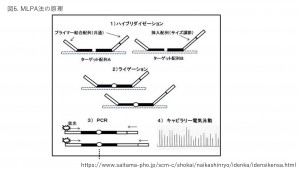
筆者がPGT-Mを行った女性の家系図です(図2)。発端者であるクライエント女性(II-7)の兄(II-5)は、24歳時に死亡しています。第2子(III-2)は出生前診断にて罹患と診断されました。遺伝学的診断はMLPA法 ( Multiplex Ligation-dependent Probe Amplification)にて診断されています。MLPA法はPCR産物の長さを重なり合わないようにプライマーを設計して、1反応で60を超える全エクソンの検出を行うことが可能となります。
MLPA法とは、DNAプローブのハイブリダイゼーションと連結(ライゲーション)、PCR増幅技術を組み合わせ、数十箇所の微細な遺伝子内部領域を調べる方法です。遺伝子内部には塩基配列が集まってできた少し大きいサイズのかたまり(エクソン)が複数存在し、これらの量的変化を評価するのに有用です。(図6)この様に同法は欠失例や挿入、重複例に有用であり、また、メチル化解析にも可能です。プローブを既知の点変異、SNP上に設計することでそれらを特異的に検出することもでき、わずか一塩基の配列の違いでも識別が可能となります。
このMLPA法が開発されたことにより、遺伝子解析は非常に短時間に正確にできるようになりました。
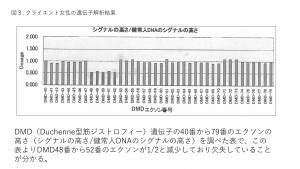
クライエント女性(II-5)ではエクソン48から52にかけてピークの高さが2分の1になっていることが分かります(図3)。エクソン欠失するタイプで、保因者と診断されました。出生前検体はMLPAを用いるが、PGT-Mでは領域を限定してプライマー設計を行います。
その後PGT-Mを施行し、6個の移植可能胚を認め、1回目の胚移植で妊娠、その後無事に健常な男児を出産しています。
筋緊張性ジストロフィー
筋緊張性ジストロフィーは、筋強直および筋萎縮が特徴で、骨格筋だけではなく多臓器を侵す常染色体優性遺伝疾患です。発症年齢が比較的高いため、親の世代での発症が見られないうちに子が妊娠し、産婦人科でも罹患に気が付かないまま分娩を迎え新生児に重篤な症状を呈する先天性筋ジストロフィーの発症で発見されることもあります。また、妊娠中の子宮収縮抑制剤の使用で横紋筋融解などを引き起こすことで妊娠管理にも留意が必要な疾患としても知られています。
その遺伝子異常は、CTGの3塩基配列のリピート回数の増幅である(トリプレットリピート病)。遺伝的特徴として特に女性を介して遺伝した場合、子に表現促進現象として、親よりもリピート回数が急激に増加して症状が重症化することが知られています。
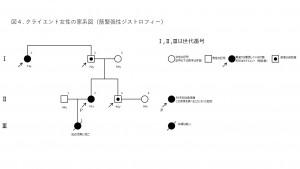
家系図(図4)を見ると、クライエント男性(Ⅱ-3)の姉(Ⅱ-2)がすでに筋強直性ジストロフィーを発症しています。その姉のサザンブロット法による遺伝学的検査の結果です(図5)。
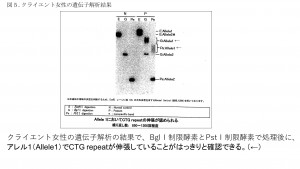
右のNが正常コントロール、左のPが患者である姉(Ⅱ-2)を表します。Pの右端のPsのレーンが制限酵素PstIで処理したDNA断片で2本あるアレルのうち、リピート回数が健常人の5~35回とされるバンドがPアレル2です。上にPアレル1があるが、少しスメア状にぼやけたバンドになっているのが伸張したアレルを表しています。アレル2に対して2.5kbから4kb程度伸長していると推定され、850~1,300回程度の増幅と判定されます。真ん中のGのレーンのBglI切断断片でも伸長が大きいため、2つのバンドとして検出されています。やはり伸長するGアレル1のバンドはスメア状で検出されています。より大きな断片として上の方にバンドが観察される左のEのEcoRI断片のレーンではアレル1は1つのバンドとして観察されます。
クライアントの父(I-2)ならびにクライアント男性(Ⅱ-3)は伸長の度合いが少なく、リピート回数は父(I-2)で48~55回、クライアント男性(Ⅱ-3)では100~150回と推定されています。また遺伝学的検査は行われていないもののクライエントの父の姉(I-1)にクライエントの姉(I-2)と同じ症状を認め、クライエントの姉の娘(III-1)が乳幼児期に死亡しているため、同疾患であった可能性が高いです。
その後PGT-Mを施行し、2個の移植可能胚を認め、1回目の胚移植で妊娠、その後無事に健常な男児を出産しています。
最後に
お子さんが成人に達する以前に日常生活が失われ、亡くなられることは精神的にも肉体的にもつらいことです。
従来行われてきた出生前診断では中絶という選別の要素が避けられない問題がありました。PGT-Mは、胚移植する受精卵を遺伝学的に選択する手段であり、中絶を避けることができます。ただし、PGT-Mを行っても染色体異数性胚のため、胚移植を行っても着床しない、もしくは流産する場合もあります。そのため、今後はPGT-Mを行う際は、PGT-Aも同時に行うことも考慮すべきだと考えます。